question 1
Lors d’une transformation chimique :
de nouvelles espèces chimiques se forment.
toutes les espèces chimiques du système réagissent.
tous les réactifs sont consommés.
question 2
Lors d’une transformation chimique, une espèce chimique spectatrice :
est entièrement consommée.
est partiellement consommée.
ne réagit pas.
question 3
On trempe un morceau de craie CaCO3(s) dans une solution d’acide chlorhydrique (H+(aq), Cl–(aq)).
Du dioxyde de carbone gazeux CO2(g), des ions calcium Ca2+(aq) et de l’eau H2O(ℓ) sont formés.
Pour cette transformation :
les réactifs sont CaCO3(s), H+(aq) et Cl–(aq).
les produits sont CO2(g), Ca2+(aq), H2O(ℓ) et Cl–(aq).
les ions Cl–(aq) sont spectateurs.
question 4
On trempe une lame de fer Fe(s) dans une solution d’acide chlorhydrique (H+(aq), Cl–(aq)).
Du dihydrogène gazeux H2(g) et des ions fer Fe2+(aq) sont formés.
L’équation de la réaction qui se produit est :
Fe(s) + H+(aq) + Cl–(aq) → H2(g) + Fe2+(aq) + Cl–(aq)
Fe(s) + 2 H+(aq) → H2(g) + Fe2+(aq)
H2(g) + Fe2+(aq) → Fe(s) + 2 H+(aq)
question 5
La masse volumique d’une espèce chimique :
est égale au quotient de la masse de cette espèce par son volume.
est égale au produit de la masse de cette espèce par son volume.
peut s’exprimer sans unité.
question 6
On considère une solution aqueuse de chlorure de sodium.
Il s’agit d’un mélange homogène.
Le soluté est le chlorure de sodium.
Le solvant est le chlorure de sodium.
question 7
Une solution aqueuse de chlorure de sodium est préparée en réalisant la dissolution de 5,85 g de chlorure de sodium dans 500 mL de solution.
Donnée : Masse molaire du chlorure de sodium : M = 58,5 g·mol–1
La concentration en masse du soluté dans cette solution est de 2,93 g·L–1.
Cette solution contient 0,10 mol de soluté.
La concentration en quantité de matière du soluté dans cette solution est de 50 mol·L–1.
question 8
L’ammoniac a pour schéma de Lewis :
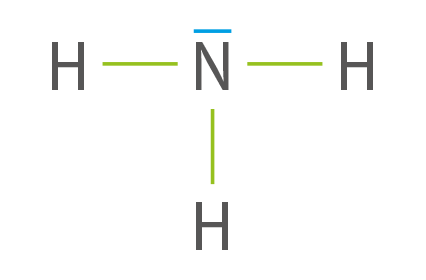
Cette molécule comporte quatre doublets.
L’atome d’hydrogène possède un doublet non liant.
L’atome d’azote possède un doublet liant.
question 9
Le diméthylformamide (DMF) est un solvant organique très utilisé. Son modèle moléculaire est le suivant.
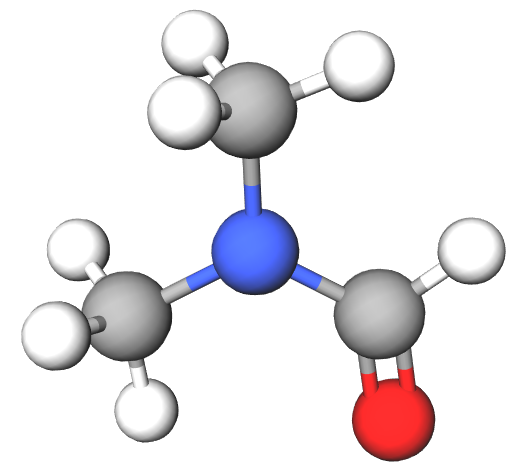
Les atomes d’hydrogène forment seulement un doublet liant chacun.
Les atomes de carbone et d’azote forment quatre doublets liants chacun.
L’atome d’oxygène doit posséder un doublet non liant pour respecter la règle de l’octet.
question 10
L’acide malique est un acide naturellement présent dans certains fruits comme les pommes ou les raisins. Sa formule semi-développée est la suivante.
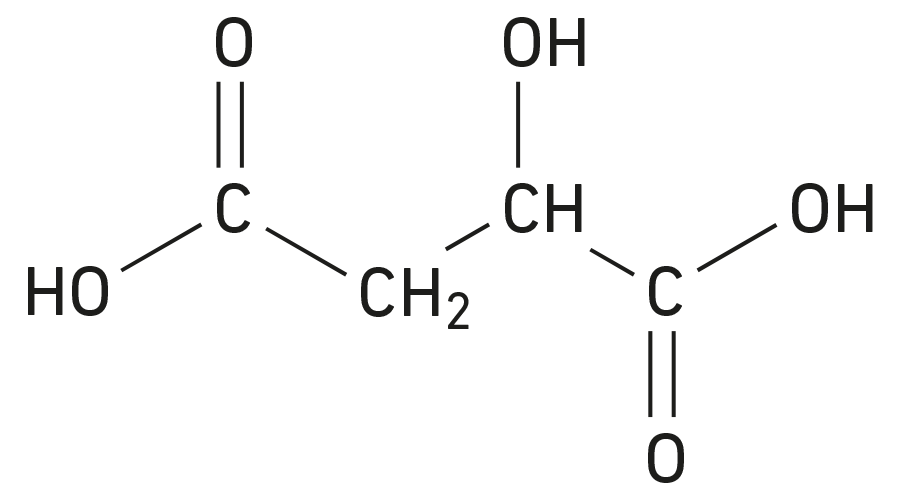
Pour obtenir la formule développée de cette molécule, il suffit de faire apparaître les liaisons avec les atomes d’hydrogène.
Pour obtenir le schéma de Lewis de cette molécule, il suffit de faire apparaître les doublets non liants.
Pour obtenir le schéma de Lewis de cette molécule, il faut faire apparaître les liaisons avec les atomes d’hydrogène.
question 11
Une liaison est polarisée si les atomes qu’elle relie :
sont différents.
possèdent des charges électriques partielles.
ont une différence d’électronégativité inférieure à 0,4.
question 12
Parmi les liaisons suivantes, laquelle ou lesquelles sont polarisées ?


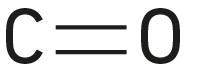
question 13
Le schéma de Lewis de la molécule de méthanol est le suivant.
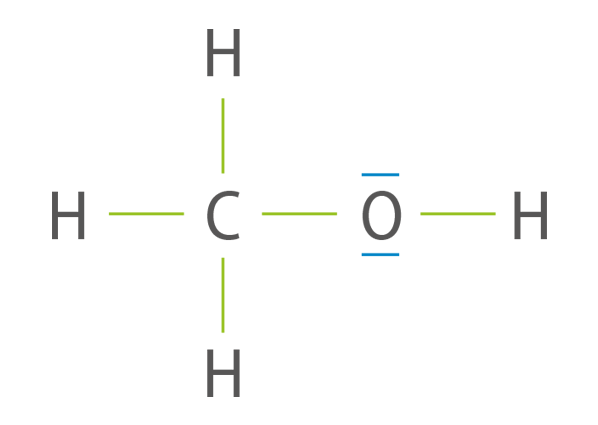
Les liaisons C–H de la molécule ne sont pas polarisées.
Si la liaison O–H venait à se rompre, l’oxygène porterait une charge négative et l’hydrogène une charge positive.
La molécule ne comporte qu’une liaison polarisée.
question 14
Si la différence d’électronégativité entre deux atomes est égale à 0,3 :
l’atome le plus électronégatif porte une charge partielle négative δ– et l’autre une charge partielle positive δ+.
la liaison covalente n’est pas polarisée.
les atomes ne portent pas de charge partielle.