Dans ce quiz, les questions sont liées les unes aux autres.
Pensez à bien noter sur une feuille vos réponses au fur et à mesure.
Question 1
Si [H3O+] = 5,0 × 10–3 mol·L–1, le pH est égal à :
–2,30
2,30
5,00
Question 2
Si pH = 3,20, [H3O+] est égale à :
6,3 × 104 mol·L–1
6,3 × 10–3 mol·L–1
6,3 × 10–4 mol·L–1
Question 3
Quelles bandes d’absorption présente cette molécule ?
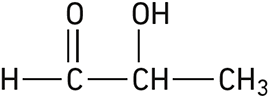
Données : Les bandes IR caractéristiques sont indiquées dans le rabat V du manuel.
vers 3 600 cm–1
vers 2 000 cm–1
vers 1 700 cm–1
Question 4
2,5 × 10–1 mol·m–3 est égal à :
2,5 × 10–4 mol·L–1
2,5 × 102 mol·L–1
2,5 × 10–3 mol·L–1
Question 5
On considère des solutions d’hydroxyde de potassium (K+(aq), HO–(aq)).
Données : Conductivités molaires ioniques :
• λHO– = 19,8 × 10–3 S·m2·mol–1
• λK+ = 7,3 × 10–3 S·m2·mol–1
On mesure une conductance
La conductivité est :
1,07 × 10–5 S·m–1
8,68 × 10–2 S·m–1
8,68 × 10–5 S·m–1
Question 6
On considère des solutions d’hydroxyde de potassium (K+(aq), HO–(aq)).
Données : Conductivités molaires ioniques :
• λHO– = 19,8 × 10–3 S·m2·mol–1
• λK+ = 7,3 × 10–3 S·m2·mol–1
Si la conductivité de la solution est σ = 8,67 × 10–2 S·m–1, sa concentration est :
3,20 × 10–3 mol·L–1
3,20 mol·L–1
3,20 mol·m–3
Question 7
On considère des solutions d’hydroxyde de potassium (K+(aq), HO–(aq)).
Données : Conductivités molaires ioniques :
• λHO– = 19,8 × 10–3 S·m2·mol–1
• λK+ = 7,3 × 10–3 S·m2·mol–1
La conductivité d’une solution à
2,71 × 10–4 S·m–1
2,71 × 10–1 S·m–1
2,71 × 102 S·m–1
Question 8
Pour doser par étalonnage une solution électrolytique incolore, on peut utiliser :
l’absorbance.
la conductance.
la conductivité.
Question 9
On considère un échantillon de gaz parfait de volume
Données : La constante des gaz parfaits est R = 8,31 J·mol–1·K–1, le zéro absolu est –273,15°C.
La température absolue est :
Question 10
On considère un échantillon de gaz parfait de volume
Données : La constante des gaz parfaits est R = 8,31 J·mol–1·K–1, le zéro absolu est –273,15°C.
La quantité de matière de gaz parfait dans l’échantillon est :
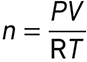
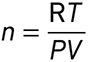
Question 11
On considère un échantillon de gaz parfait de volume
Données : La constante des gaz parfaits est R = 8,31 J·mol–1·K–1, le zéro absolu est –273,15°C.
La quantité de matière de gaz dans l’échantillon est :
1,94 × 10–1 mol
1,62 mol
1,94 × 102 mol
 QCM
QCM