question 1
L’absorbance d’une solution :
est grande si la solution est très opaque.
est grande si la solution est très transparente.
est nulle si la solution est parfaitement transparente.
question 2
Une solution qui absorbe uniquement le bleu paraît :
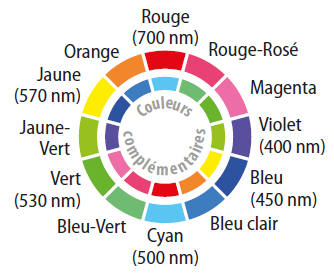
rouge.
bleue.
jaune.
question 3
D’après la loi de Beer-Lambert, l’absorbance d’une solution est proportionnelle à :
la concentration de l’espèce chimique absorbante.
l’épaisseur de solution traversée.
la longueur d’onde de travail.
question 4
Un spectre d’absorption est la représentation graphique :
de la longueur d’onde en fonction de la concentration.
de l’absorbance en fonction de la concentration.
de l’absorbance en fonction de la longueur d’onde.
question 5
Un spectre infrarouge donne la représentation graphique :
de la transmittance en fonction du nombre d’onde.
du nombre d’onde en fonction de la transmittance.
de la transmittance en fonction de la longueur d’onde.
question 6
L’équation de dissolution de Fe2(SO4)3 (s) est :
Fe2(SO4)3 (s) → 2 Fe3+(aq) + 3 SO42–(aq)
Fe2(SO4)3 (s) → 3 Fe3+(aq) + 2 SO42–(aq)
Fe2(SO4)3 (s) → Fe2+ (aq) + (SO4)3– (aq)
question 7
Selon le spectre d’absorption d’une solution de permanganate de potassium, la couleur absorbée par la solution est :
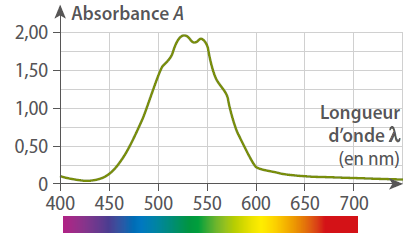
le jaune.
le vert.
le violet.
question 8
Une solution absorbant les radiations vers 530 nm paraît :

jaune.
verte.
magenta.
question 9
Dans un dosage par étalonnage colorimétrique, il faut :
réaliser une échelle de teintes en diluant la solution à tester.
parfois diluer la solution à tester.
réaliser une échelle de teintes en diluant une solution connue.
question 10
On trace l’évolution de l’absorbance en fonction de la concentration lors d’un dosage par étalonnage spectrophotométrique. Si la loi de Beer-Lambert est vérifiée, la courbe-modèle est :
une parabole.
une droite passant par l’origine.
une droite ne passant pas par l’origine.
question 11
On obtient la courbe suivante lors d’un dosage par étalonnage spectrophotométrique d’une solution de sulfate de cuivre :
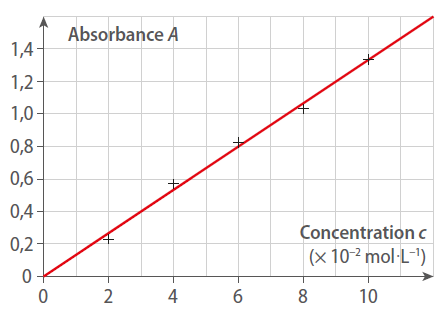
L’absorbance de la solution dosée est A = 1,2. La concentration de la solution est donc :
question 12
Un spectre infrarouge permet :
de déterminer les groupes caractéristiques d’une molécule.
de déterminer le nombre d’atomes de carbone qu’une molécule contient.
de déterminer les liaisons chimiques présentes dans une molécule.
question 13
La molécule dont le spectre infrarouge (IR) est représenté ci-dessous :
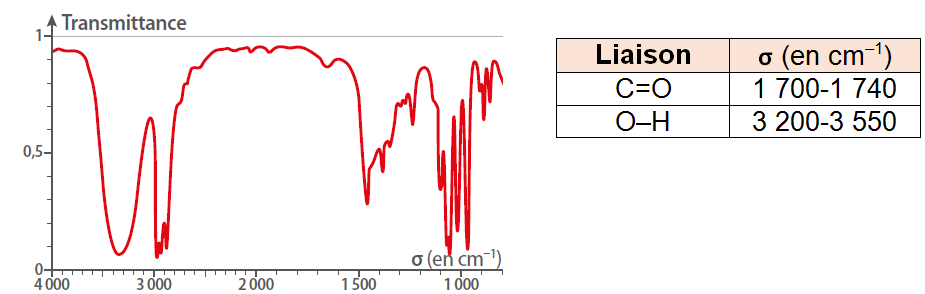
contient une liaison O–H.
contient une liaison C=O.
peut être un alcool.