Question 1
La solution titrante est celle :
dont on connaît la concentration.
dont on cherche la concentration.
qui est placée dans la burette.
Question 2
La solution titrée est celle :
dont on cherche la concentration.
qui est placée dans le bécher.
dont on connaît la concentration.
Question 3
À l’équivalence, le mélange :
contient du réactif titré.
contient du réactif titrant.
ne contient ni l’un ni l’autre.
Question 4
Avant l’équivalence, le mélange réactionnel contient :
du réactif titrant.
du réactif titré.
des produits de la réaction.
Question 5
Après l’équivalence, le mélange réactionnel contient :
le réactif titrant ajouté après l’équivalence.
du réactif titré.
uniquement des produits.
Question 6
On peut réaliser un titrage conductimétrique si :
la réaction support de titrage met en jeu des ions.
la réaction support de titrage est de type acide-base.
on peut mesurer la conductance du mélange réactionnel.
Question 7
Lors d’un titrage conductimétrique, on ajoute de l’eau distillée dans le bécher pour :
avoir un volume équivalent proche de 10,0 mL.
pouvoir négliger la dilution lors de l’ajout de solution titrante.
que la conductivité soit plus élevée.
Question 8
Lors d’un titrage conductimétrique, le volume équivalent sur la courbe de titrage est l’abscisse :
de son minimum.
de son maximum
de l’intersection des droites qui modélisent les points expérimentaux.
Question 9
Un titrage pH-métrique implique :
que le réactif titrant soit un acide si le réactif titré est une base.
que des ions soient mis en jeu.
que les réactifs titrant et titré soient des acides.
Question 10
Le graphique ci-dessous :
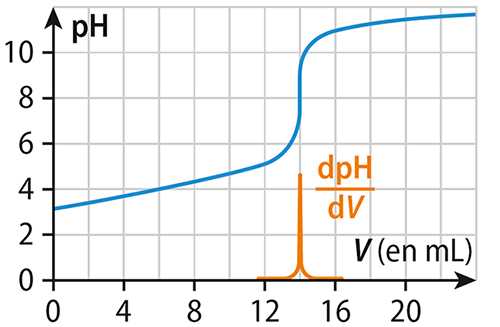
correspond au titrage d’une base par un acide.
correspond au titrage d’un acide par une base.
présente deux courbes de titrage.
Question 11
D’après le graphique ci-dessous, le volume équivalent vaut :

11,5 mL.
14,0 mL.
16,5 mL.
 QCM
QCM