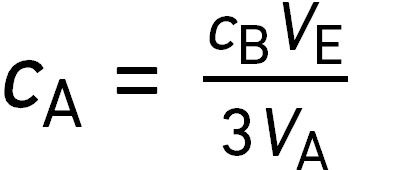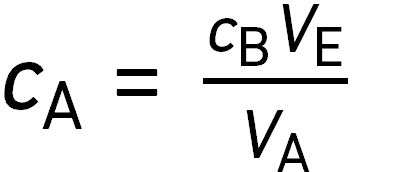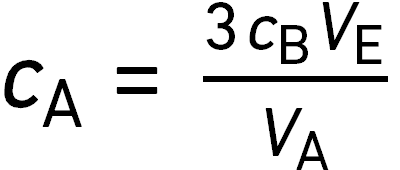On veut préparer un volume
Donnée : Masse molaire de l’hydroxyde de sodium NaOH :
question 1
Pour préparer cette solution par dissolution, il faut utiliser :
une fiole jaugée de 200,0 mL.
une éprouvette graduée de 200 mL.
une burette graduée de 200 mL.
On veut préparer un volume
Donnée : Masse molaire de l’hydroxyde de sodium NaOH :
question 2
Pour préparer cette solution par dissolution, il faut peser une masse d’hydroxyde de sodium :
On veut préparer un volume
Donnée : Masse molaire de l’hydroxyde de sodium NaOH :
question 3
Pour préparer cette solution par dilution d’une solution mère de concentration
question 4
La demi-équation du couple H2O(ℓ)/HO–(aq) est :
H2O(ℓ) + H+ = HO–(aq)
HO–(aq) + H+ = H2O(ℓ)
H2O(ℓ) = HO–(aq) + H+
question 5
Les couples acide-base de l’eau sont :
H2O(ℓ)/H3O+(aq) et H2O(ℓ)/HO–(aq).
H3O+(aq)/H2O(ℓ) et HO–(aq)/H2O(ℓ).
H3O+(aq)/H2O(ℓ) et H2O(ℓ)/HO–(aq).
question 6
Soient les couples NH4+(aq)/NH3(aq) et H2O(ℓ)/HO–(aq).
On peut envisager les réactions :
NH4+(aq) + H2O(ℓ) → HO–(aq) + NH3(aq)
NH4+(aq) + HO–(aq) → NH3(aq) + H2O(ℓ)
NH3(aq) + H2O(ℓ) → NH4+(aq) + HO–(aq)
On considère une solution d’hydroxyde de sodium (Na+(aq), HO–(aq)).
question 7
On mesure une conductance
La conductivité est :
1,07 × 10–5 S·m–1
8,68 × 10–2 S·m–1
8,68 × 10–5 S·m–1
On considère une solution d’hydroxyde de sodium (Na+(aq), HO–(aq)).
Données : conductivités molaires ioniques :
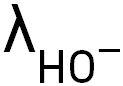 = 19,8 × 10–3 S·m2·mol–1
= 19,8 × 10–3 S·m2·mol–1
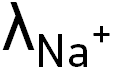 = 5,0 × 10–3 S·m2·mol–1
= 5,0 × 10–3 S·m2·mol–1
question 8
Si la conductivité de la solution est σ = 8,68 × 10–2 S·m–1, sa concentration est :
3,50 × 10–3 mol·L-1
3,50 mol·L–1
3,50 mol·m–3
On considère une solution d’hydroxyde de sodium (Na+(aq), HO–(aq)).
Données : conductivités molaires ioniques :
 = 19,8 × 10–3 S·m2·mol–1
= 19,8 × 10–3 S·m2·mol–1
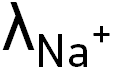 = 5,0 × 10–3 S·m2·mol–1
= 5,0 × 10–3 S·m2·mol–1
question 9
La conductivité d’une solution de concentration apportée
2,48 × 10–4 S·m–1.
2,48 × 10–1 S·m–1.
2,48 × 102 S·m–1.
On verse dans un erlenmeyer un volume
On y ajoute progressivement une solution contenant l’espèce chimique B de concentration
De toutes les espèces, seule B est colorée. Le volume équivalent est
question 10
Pour ce titrage, A est :
la solution titrée.
le réactif titré.
le réactif titrant.
On verse dans un erlenmeyer un volume
On y ajoute progressivement une solution contenant l’espèce chimique B de concentration
De toutes les espèces, seule B est colorée. Le volume équivalent est
question 11
La solution contenant B est initialement placée :
dans un erlenmeyer.
dans une burette graduée.
sur agitation magnétique.
On verse dans un erlenmeyer un volume
On y ajoute progressivement une solution contenant l’espèce chimique B de concentration
De toutes les espèces, seule B est colorée. Le volume équivalent est
question 12
L’équivalence est repérée par :
la disparition de la couleur de A.
la disparition de la couleur de B.
la persistance de la couleur de B.
On verse dans un erlenmeyer un volume
On y ajoute progressivement une solution contenant l’espèce chimique B de concentration
De toutes les espèces, seule B est colorée. Le volume équivalent est
question 13
La concentration de A dans la solution titrée vérifie :