Dans ce quiz, les questions sont liées les unes aux autres.
Pensez à bien noter sur une feuille vos réponses au fur et à mesure.
Soient les demi-équations HCO3–(aq) + H+ = H2CO3 (aq) et HCO3–(aq) = CO32–(aq) + H+.
question 1
Les couples mis en jeu sont :
HCO3–(aq)/H2CO3 (aq) et HCO3–(aq)/CO32–(aq)
H2CO3 (aq)/HCO3–(aq) et HCO3–(aq)/CO32–(aq)
HCO3–(aq)/H2CO3 (aq) et CO32–(aq)/HCO3–(aq)
Soient les demi-équations HCO3–(aq) + H+ = H2CO3 (aq) et HCO3–(aq) = CO32–(aq) + H+.
question 2
HCO3–(aq) est :
l’acide conjugué de H2CO3 (aq).
un acide au sens de Brönsted.
une espèce amphotère.
question 3
On considère la réaction suivante :
H2CO3 (aq) + HO–(aq) → HCO3–(aq) + H2O(ℓ)
Cette réaction met en jeu un transfert d’ion hydrogène de :
HO–(aq) vers H2CO3 (aq)
H2CO3 (aq) vers HCO3–(aq)
H2CO3 (aq) vers HO–(aq)
question 4
Une solution d’acide sulfurique (2 H3O+(aq), SO42–(aq)) de concentration c = 1,0 × 10–2 mol·L–1 :
contient des ions oxonium à la concentration [H3O+]éq = 2,0 × 10–2 mol·L–1.
a un pH égal à 2,0.
a un pH inférieur à 2,0.
question 5
Soient une solution d’acide chlorhydrique (H3O+(aq), Cl–(aq)) et une solution d’acide sulfurique (2 H3O+(aq), SO42–(aq)) de pH = 2,00.
Les deux solutions ont la même concentration en ions oxonium.
Les deux solutions ont la même concentration apportée.
La solution d’acide sulfurique contient plus d’ions oxonium que la solution d’acide chlorhydrique.
question 6
On dilue dix fois une solution d’acide chlorhydrique (H3O+(aq), Cl–(aq)) de pH = 2,00.
Le pH de la solution diminue d’une unité.
Le pH de la solution est divisé par 10.
Le pH de la solution augmente d’une unité.
question 7
La mesure du pH d’une solution :
n’est pas sensible à la température.
ne nécessite pas d’étalonnage préalable du pH-mètre.
doit être faite avec une sonde propre et sèche.
question 8
On s’intéresse à la réaction d’équation N2 + 3 H2 → 2 NH3.
La transformation est totale.
Son avancement maximal est égal à son avancement final.
N2, H2 et NH3 sont présents à l’état final.
Le mélange final ne contient que NH3.
On fait réagir n1 = 2,0 mol de méthanoate d’éthyle C3H6O2 avec n2 = 2,0 mol d’eau.
On obtient n3 = 0,66 mol d’acide méthanoïque CH2O2 et n4 = 0,66 mol d’éthanol C2H6O.
question 9
Cette transformation :
est totale.
a un taux d’avancement final égal à 33 %.
a un taux d’avancement final égal à 66 %.
On fait réagir n1 = 2,0 mol de méthanoate d’éthyle C3H6O2 avec n2 = 2,0 mol d’eau.
On obtient n3 = 0,66 mol d’acide méthanoïque CH2O2 et n4 = 0,66 mol d’éthanol C2H6O.
question 10
Dans l’état final de cette transformation :
le système ne contient que C3H6O2 et H2O.
le système est composé de C3H6O2, C2H6O, CH2O2 et H2O.
le système ne contient que C2H6O et CH2O2.
question 11
On considère la réaction HCOOH(aq) + NH3(aq) ⇌ HCOO–(aq) + NH4+(aq).
Sa constante d’équilibre s’écrit :
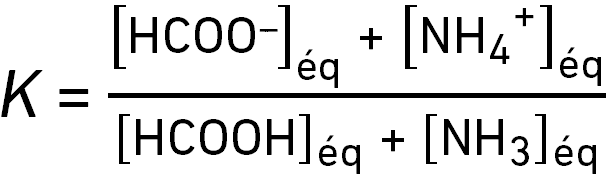
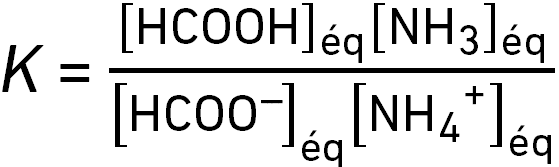
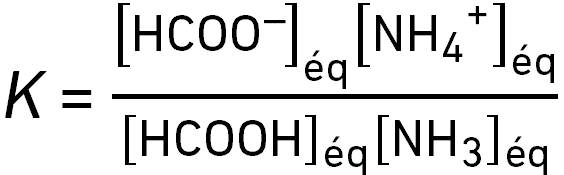
question 12
On considère un système chimique siège d’une réaction non totale. Le quotient de réaction est supérieur à la constante d’équilibre.
Le système évolue spontanément dans le sens direct.
Le système évolue spontanément dans le sens indirect.
L’équilibre est atteint.
question 13
À l’équivalence d’un titrage :
on a apporté juste assez de réactif titrant pour consommer tout le réactif titré initialement présent.
on a apporté autant de réactif titrant qu’il y avait initialement de réactif titré.
le réactif titrant et le réactif titré sont présents dans les proportions stœchiométriques.
question 14
On verse dans un erlenmeyer un volume VA d’une solution contenant l’espèce chimique A de concentration inconnue cA. On y ajoute progressivement une solution contenant l’espèce chimique B de concentration cB connue.
L’équation de la réaction support du titrage est 3 A + B → C + 2 D.
De toutes les espèces, seule B est colorée. Le volume équivalent est VE.
La quantité de matière de B apportée à l’équivalence est :
cBVE
cAVA
3cAVA