question 1
L’acétone est un solvant organique de formule C3H6O. Sa formule semi-développée est :
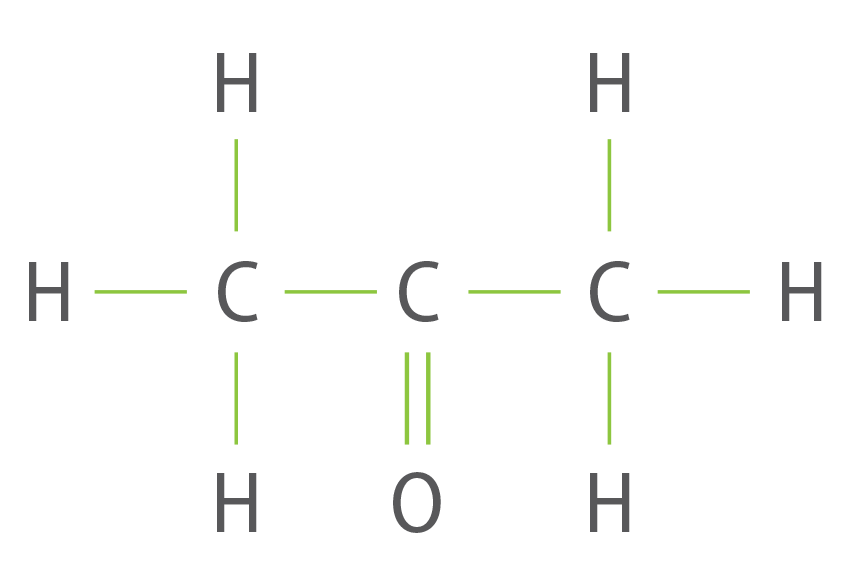
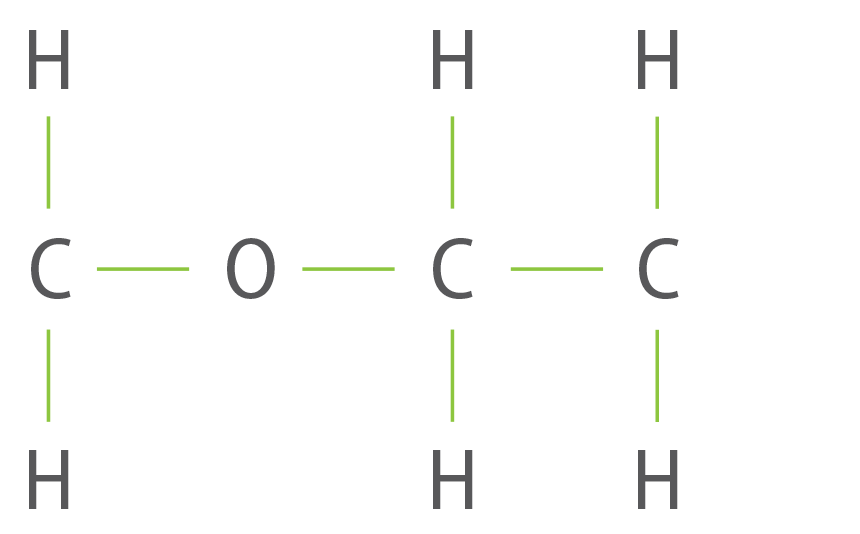
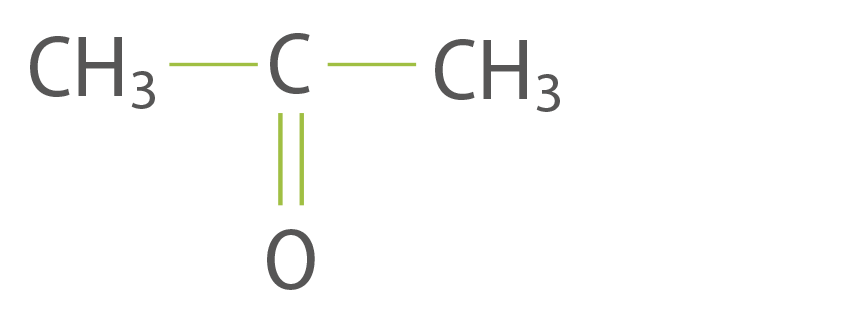
question 2
La formule semi-développée de l’acide propanoïque est :
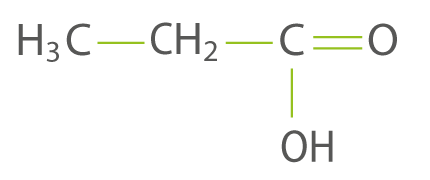
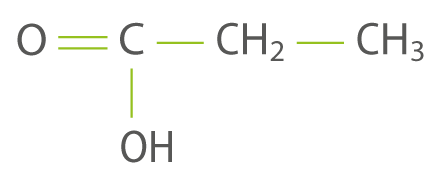
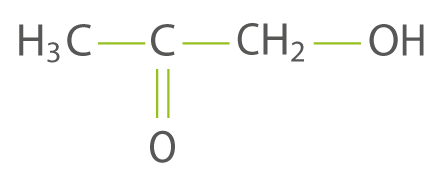
question 3
La molécule suivante possède :
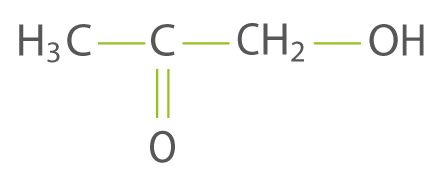
Un groupe carboxyle.
Un groupe hydroxyle.
Un groupe carbonyle.
question 4
Un aldéhyde possède :
un groupe carbonyle sur un carbone de bout de chaîne.
un groupe carboxyle sur un carbone de bout de chaîne.
un groupe hydroxyle sur un carbone de bout de chaîne.
question 5
Le chauffage à reflux est utilisé lors de l’étape de :
transformation.
séparation.
purification.
question 6
À quoi sert l’étape d’identification ?
À faire une CCM.
À vérifier la nature et la pureté du produit.
À éliminer les impuretés.
question 7
Pour calculer le rendement expérimental d’une synthèse, il faut :
que le produit obtenu soit pur.
faire un bilan de matière.
que le produit soit solide.
question 8
On a synthétisé 40 mmol de produit alors qu’on en attendait théoriquement 50 mmol.
Le rendement vaut 80.
Le rendement vaut 0,80.
Le rendement vaut 80 %.
question 9
Parmi les réactions suivantes, laquelle ou lesquelles sont des réactions acide-base :
HCO3– (aq) + CH2O2 (aq) → H2CO3 (aq) + CHO2– (aq)
2 C6H8O6 (aq) + 2 H2O(ℓ) → 2 C6H6O6 (aq) + 8 H+(aq) + O2 (g)
Cu2+ (aq) + Fe(s) → Cu(s) + Fe2+(aq)
question 10
Pour accélérer l’évolution d’une réaction chimique, on peut :
augmenter la concentration des réactifs.
diminuer la température.
diluer le mélange réactionnel.
question 11
Un catalyseur :
diminue la durée d’une réaction chimique.
n’apparaît pas dans l’équation de réaction.
modifie l’état final du système chimique.
On introduit dans un bécher une lame d’argent, une lame de plomb, une solution contenant des ions Ag+ et une solution contenant des ions Pb2+.
La réaction susceptible de se produire est un équilibre chimique d’équation :
2 Ag+ (aq) + Pb(s) ⇌ 2 Ag(s) + Pb2+(aq)
question 12
Du plomb solide Pb(s) est formé si :
le quotient de réaction Qr est égal à la constante d’équilibre K(T).
le quotient de réaction Qr est inférieur à la constante d’équilibre K(T).
le quotient de réaction Qr est supérieur à la constante d’équilibre K(T).
On introduit dans un bécher une lame d’argent, une lame de plomb, une solution contenant des ions Ag+ et une solution contenant des ions Pb2+.
La réaction susceptible de se produire est un équilibre chimique d’équation :
2 Ag+ (aq) + Pb(s) ⇌ 2 Ag(s) + Pb2+(aq)
question 13
Pour augmenter la valeur du quotient de réaction, on peut :
augmenter la masse de la lame d’argent.
augmenter la concentration en ion Pb2+ de la solution.
diluer la solution contenant des ions Pb2+.