Question 1
L’eau H2O est un acide de Brönsted car :
elle peut capter un électron.
elle peut capter un ion hydrogène H+.
elle peut céder un ion hydrogène H+.
Question 2
Soit la demi-équation acido-basique : CH3—NH2 (aq) + H+ = CH3—NH3+(aq)
Le couple mis en jeu est CH3—NH2 (aq)/CH3—NH3+(aq).
CH3—NH2 (aq) est une base.
CH3—NH2 (aq) capte un ion H+ pour former sa base conjuguée CH3—NH3+(aq).
Question 3
La demi-équation du couple H3O+(aq)/H2O(ℓ) est :
H3O+(aq) + H+ = H2O(ℓ).
H3O+(aq) = H2O(ℓ) + H+.
H2O(ℓ) + H+ = H3O+(aq).
Question 4
Les couples acide-base de l’eau sont :
H2O(ℓ)/H3O+(aq) et H2O(ℓ)/HO–(aq).
H3O+(aq)/H2O(ℓ) et H2O(ℓ)/HO–(aq).
H3O+(aq)/H2O(ℓ) et HO–(aq)/H2O(ℓ).
Question 5
Les espèces chimiques suivantes sont des acides de Brönsted :
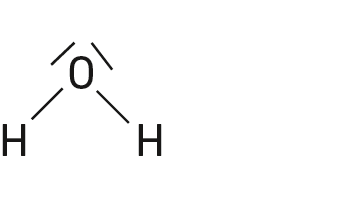
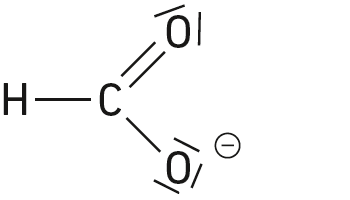
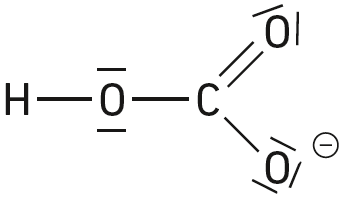
Question 6
On considère les demi-équations :
HCO3–(aq) + H+ = H2CO3 (aq) et HCO3–(aq) = CO32–(aq) + H+.
Les couples mis en jeu sont :
HCO3–(aq)/H2CO3 (aq) et HCO3–(aq)/CO32–(aq).
H2CO3 (aq)/HCO3–(aq) et HCO3–(aq)/CO32–(aq).
HCO3–(aq)/H2CO3 (aq) et CO32–(aq)/HCO3–(aq).
Question 7
On considère les demi-équations :
HCO3–(aq) + H+ = H2CO3 (aq) et HCO3–(aq) = CO32–(aq) + H+.
H2CO3 (aq) est :
un acide au sens de Brönsted.
une base au sens de Brönsted.
une espèce amphotère.
Question 8
Lors d’une réaction acide-base :
un ion hydrogène est transféré de la base d’un couple vers l’acide d’un autre.
un ion hydrogène est transféré de l’acide d’un couple vers la base d’un autre.
l’acide d’un couple cède un ion hydrogène à sa base conjuguée.
Question 9
La réaction acide-base entre CH3—NH2 et H3O+ :
a pour équation CH3—NH2 + H3O+ → CH3—NH3+ + H2O
a pour équation CH3—NH3+ + H2O → CH3—NH2 + H3O+
implique un transfert d’ion hydrogène de CH3—NH2 vers H3O+.
Question 10
Soient les couples NH4+(aq)/NH3 (aq) et H2O(ℓ)/HO–(aq).
On peut envisager les réactions :
NH4+(aq) + H2O(ℓ) → HO–(aq) + NH3 (aq)
NH4+(aq) + HO–(aq) → NH3 (aq) + H2O(ℓ)
NH3 (aq) + H2O(ℓ) → NH4+(aq) + HO–(aq)
Question 11
On considère la réaction suivante :
H2CO3 (aq) + HO–(aq) → HCO3–(aq) + H2O(ℓ).
Cette réaction met en jeu un transfert d’ion hydrogène de :
HO–(aq) vers H2CO3 (aq).
H2CO3 (aq) vers HCO3–(aq).
H2CO3 (aq) vers HO–(aq).
Question 12
On considère la réaction suivante :
H2CO3 (aq) + HO–(aq) → HCO3–(aq) + H2O(ℓ).
Les couples mis en jeu sont :
H2CO3 (aq)/HO–(aq) et HCO3–(aq)/H2O(ℓ).
HO–(aq)/H2O(ℓ) et HCO3–(aq)/H2CO3 (aq).
H2O(ℓ)/ HO–(aq) et H2CO3 (aq)/HCO3–(aq).
 QCM
QCM